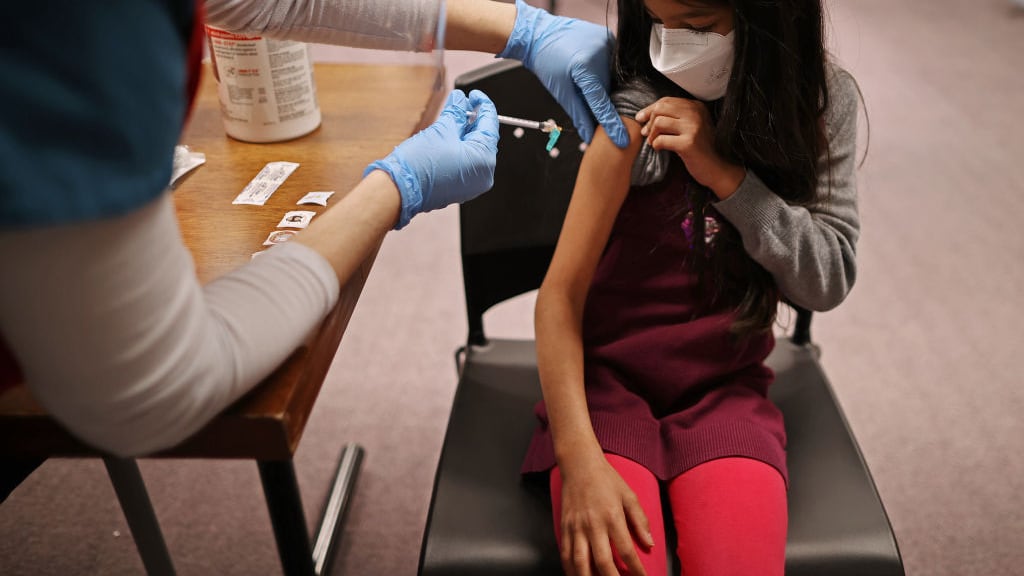
La empresa Moderna anunció este jueves que presentó una solicitud de autorización para que su vacuna contra el Covid-19 pueda ser administrada a menores de 6 años en Estados Unidos, el único grupo etario que hasta ahora no ha tenido acceso a estos fármacos en este y en muchos otros países. “Creemos que (esta vacuna) podrá proteger de forma segura a estos niños contra el SARS-CoV-2, lo cual es tan importante en nuestra lucha continua contra el Covid-19 y será especialmente bien recibida por los padres y cuidadores”, dijo en un comunicado Stephane Bancel, CEO de Moderna.
PUBLICIDAD
En marzo, la firma anunció los resultados de un estudio que demostró que el régimen de dos inyecciones era seguro y producía una fuerte respuesta inmunitaria. Se determinó que dos dosis de 25 microgramos administradas a bebés, niños pequeños y preescolares generaron niveles similares de anticuerpos que dos dosis de 100 microgramos administradas a jóvenes de entre 18 y 25 años, con lo que se lograrían niveles similares de protección contra los casos graves del virus. La prueba incluyó a 4 mil 200 niños de entre 2 y 6 años y 2 mil 500 bebés de entre 6 meses y 2 años. Los efectos secundarios fueron, en general, leves y similares con los observados en grupos de mayor edad. Sin embargo, la empresa encontró una eficacia relativamente baja para enfrentar la infección. La eficacia de la vacuna en niños de 6 meses a dos años fue del 51 %, y del 37 % en el grupo de edad de dos a cinco años.
Obstáculos para la autorización
Moderna dijo que actualmente está estudiando las dosis de refuerzo para los niños de todas las edades. Pero la menor eficacia de las dos dosis puede suponer un obstáculo para la autorización. En febrero, la agencia de Alimentos y Medicamentos (FDA) aplazó la reunión de un grupo de expertos para estudiar la vacuna contra el Covid-19 de Pfizer–BioNTech para niños menores de 5 años, con el argumento de que quería ver los datos sobre el rendimiento de las tres dosis antes de estudiar el asunto. La vacuna de Pfizer, administrada en dos dosis de tres microgramos a niños de entre 6 meses y 2 años, provocó un nivel de anticuerpos similar al de los 30 microgramos administrados a personas de entre 16 y 25 años, pero no ocurrió lo mismo con los niños de entre dos y cuatro años.
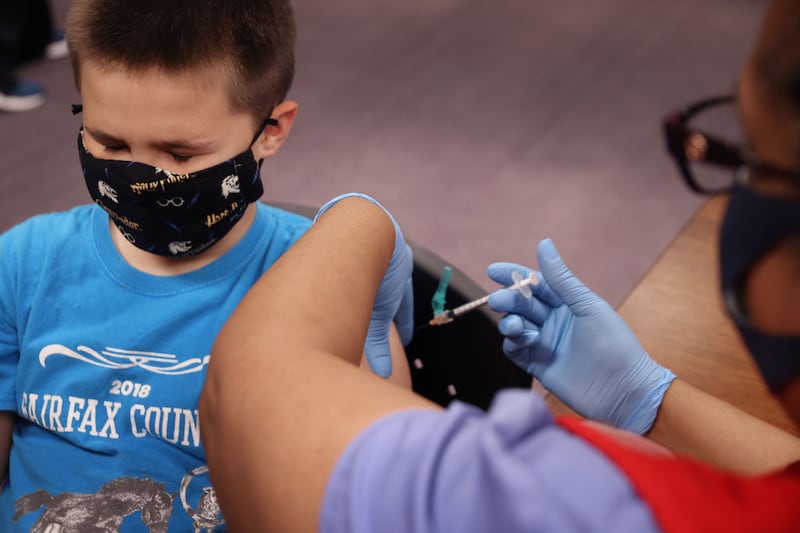
Esta semana, el director ejecutivo de Pfizer, Albert Bourla, declaró en una entrevista que su empresa aspiraba a poner a disposición esas vacunas antes de junio, si los organismos reguladores estaban de acuerdo. La vacuna de Moderna solo está autorizada actualmente para adultos mayores de 18 años en Estados Unidos, mientras que la de Pfizer está disponible a partir de los cinco años. Moderna está buscando por separado la autorización para niños mayores.
*Con información de AFP